تعاریف آنمی اپلاستیک
از لحاظ تاریخی، اصطلاح “کم خونی آپلاستیک” وضعیت بالینی را مشخص می کند که در آن بیماران با کم خونی و مغز استخوان فاقد سلول مراجعه می کنند.از سال 1885، زمانی که پل ارلیش اولین مورد آنمی آپلاستیک یا اصطلاح اولیه ان “شکست مغز استخوان” را در یک زن باردار توصیف کرد، شواهد نشان داد که این بیماری فارغ از انواع دسته بندی های بیولوژیک و بالینی دارای ویژگی های متعدد بافت شناسی، مولکولی و بالینی مشترک است.
در ادامه اصطلاح “آپلازی” با اصطلاح “شکست مغز استخوان” جایگزین شده است که نشان دهنده کاهش چشمگیر تولید یک یا چند دودمان خونساز است که منجر به کاهش یا عدم وجود پیش سازهای خونسازدر مغز استخوان میشود که متعاقبا سبب سیتوپنی (های) خون محیطی می شود.(1)
ویژگی های پاتوفیزیولوژیک:
آسیب مستقیم به استخوان
اغلب آسیب های جدی که به مغز استخوان وارد می شود در اثر شیمی درمانی یا پرتودرمانی رخ می دهد. اثرات اغلب وابسته به دز و گذرا است. سایر سیتمهای بدن نیز تحت تاثیر قرار می گیرند ولی انتظار بهبودی خود به خودی وجود دارد. علاوه بر این موارد “بنزن” نیز ماده ای است که خون سازی را مختل می کند و قرار گرفتن در معرض بنزن صنعتی یکی از عوامل اساسی ابتلا به آنمی آپلاستیک می تواند در نظر گرفته شود.
البته امروزه قرار گرفتن در معرض بنزن یک ریسک فاکتور ناچیزبوده و تنها بخش کوچکی از دلایل نارسایی مغز استخوان را در اکثر کشور ها به خود اختصاص داده است. در مورد بنزن دز و زمان مواجهه بسیار مهم است، به نظر می رسد کارگرانی که در معرض بنزن شدیدتر یا طولانی تر قرار دارند سیتوپنی خفیف تری دارند و پس از پایان مواجهه بهبود می یابند. نارسایی مغز یک اثر نزدیک و نه یک پیامد دیررس قرار گرفتن در معرض بنزن است.
سندروم های ارثی
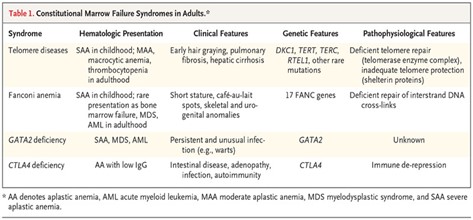
نارسایی مغز ناشی از جهشهای ژرمینال با از دست دادن عملکرد خاص می باشد که معمولاً به ارث میرسد(جدول 1). طیفی از ضایعات ژنتیکی وجود دارد که ظرفیت سلولهای بنیادی خونساز را برای ترمیم DNA کاهش میدهد، مانند کمخونی فانکونی، دیسکراتوزیس مادرزادی و کمبود GATA2.
نارسایی مغز استخوان همچنین ممکن است در سندرمهایی که بر تنظیم ایمنی تأثیر میگذارند، مانند سندرمهای ناشی از جهشهای آنتیژن مرتبط با لنفوسیت T سیتوتوکسیک (CTLA-4) و کمبود آدنوزین دآمیناز 2 رخ دهد. 9 سندرم های ارثی به طور کلاسیک در دوران کودکی، اغلب با ناهنجاری های فیزیکی مشخص ظاهر می شوند.
به طور معمول، چندین اندام درگیر هستند. سابقه خانوادگی ممکن است بستگان مبتلا را مشخص کند. با این حال، آزمایشات ژنتیکی و ژنومی نشان داده است که کمبودهای ژنتیکی می تواند در بزرگسالان ظاهر شود، که ممکن است بدون این ویژگی های معمولی ظاهر شوند. تشخیص علت زایا برای هدایت درمان بسیار مهم است و عواقبی برای اعضای خانواده دارد.
در مؤسسه ملی بهداشت، در میان کودکان و بزرگسالانی که برای درمانهای پروتکلی مراجعه میکنند، جهشهای بیماریزای غیرمنتظره در بیماران مبتلا به آنمی اپلاستیک شدید بسیار غیرمعمول بود، اما در بیماران مبتلا به نارسایی متوسط مغز استخوان بسیار شایعتر بود .
آنمی آپلاستیک ایمیون
تقریباً تمام موارد پراکنده آنمی آپلاستیک، به ویژه زمانی که شدید و حاد باشد، به نظر می رسد که با واسطه ایمنی باشد. قویترین و مرتبطترین شواهد برای اثبات مکانیسم ایمنی، بهبود شمارش خون پس از انواع درمانهای سرکوبکننده سیستم ایمنی و ارتباط شمارش کافی سلول ها پس از بهبودی با مهارکنندههای نگهدارنده کلسینئورین (معمولاً سیکلوسپورین) است.
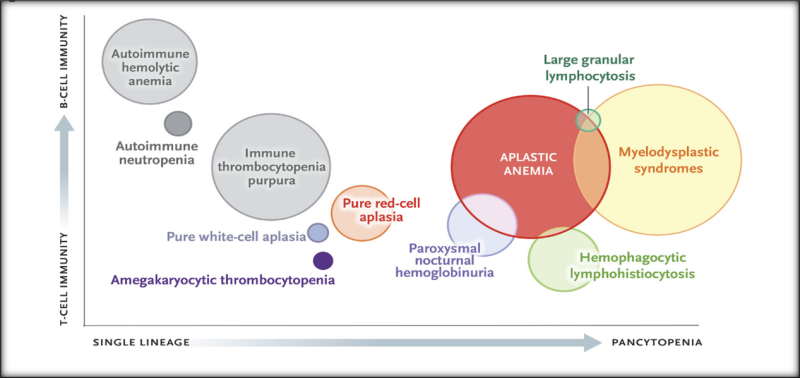
آنمی آپلاستیک با بیماریهای ایمونولوژیک (به ویژه سرونگاتیو هپاتیتیو، فاسییت ائوزینوفیلیک و تیموما ) مرتبط است. اما اکثر موارد آنمی آپلاستیک علت مشخصی ندارند و به آنها برچسب ایدیوپاتیک داده شده است. آنمی آپلاستیک ایمنی در طیفی از بیماری های مغز استخوان و سلول های خونی قرار دارد(شکل 1).
شکل 1.گروهی از بیماری های مرتبط با کم خونی اپلاستیک ایمنی
تشخیص آنمی اپلاستیک :
وجود مغز استخوان چرب یک ویژگی اصلی تشخیصی کم خونی آپلاستیک است، اما امروزه آزمایشات پیچیده در تشخیص اختلالات پاتوفیزیولوژیکی مختلف و تمایز بین بیماری های مشابه و گاهی اوقات همپوشانی در تشخیص افتراقی انجام می شود(شکل1). تشخیص دقیق برای درمان مناسب و مدیریت موثر مورد نیاز است.
تشخیص افتراقی نارسایی اکتسابی مغز از استخوان نارسایی ارثی
غربالگری ژنومی مکمل آزمایش عملکردی برای کم خونی فانکونی (که با آسیب کروموزومی پس از استرس کلاستوژنیک مشخص می شود) و تلومروپاتی ها (که با تلومرهای کوتاه شده مشخص می شود) است. با این حال، غربالگری جامع ژرملاین بر هزینه ارزیابی می افزاید و نتایج ممکن است برای چند هفته در دسترس پزشک نباشد.
غربالگری تقریباً 50 ژنی که باعث نارسایی مغز استخوان می شوند به ویژه در پان سیتوپنی متوسط و مزمن، ترومبوسیتوپنی و کم خونی ماکروسیتیک در کودکان و نوجوانان؛ و در بیمارانی که درمان سرکوب کننده سیستم ایمنی در آنها شکست خورده است، ارزشمند است. در بیماران مبتلا به پان سیتوپنی شدید که سابقه خانوادگی، ویژگی های بالینی یا شواهدی از درگیری اندام فراتر از مغز استخوان ندارند، غربالگری احتمالاً مثبت نیست.
تشخیص افتراقی آنمی آپلاستیک از میلودیسپلازی هیپوپلاستیک
جهش های اکتسابی در غربالگری ژنومی ژن های جهش یافته مکرر در MDS و AML شناسایی می شوند. چنین آزمایشی زمانی ارزشمند است که به MDS مشکوک باشد .MDS هیپوسلولار ممکن است از ظاهر مغز استخوان، به ویژه مگاکاریوسیت های دیسپوئیتیک، پیشنهاد شود، و تعداد طبیعی یا افزایش سلول های CD34 با کم خونی آپلاستیک سازگار نیست. فلوسایتومتری سلولهای CD34 را شمارش میکند و فنوتیپهای غیرعادی را شناسایی میکند که نشاندهنده تمایز نابجا هستند.
آزمایش ژنومی ممکن است مفید باشد، زیرا جهشهای ژن اسپلایسئوزوم و ژنهای جهشیافته متعدد مشخصه MDS هستند اما برای کمخونی آپلاستیک نیستند. ژن های خاص، احتمال یک جهش ژنی و اندازه کلون – هر دو مشابه الگوی آنمی آپلاستیک و متمایز از الگوی افراد معمولی و بیماران مبتلا به انواع نرموسلولار و هیپرسلولی MDS است. یافته های DNMT3A- یا ASXL1 -کلون جهش یافته تشخیص کم خونی آپلاستیک یا احتمال پاسخ به درمان را تغییر نمی دهد.
تشخیص افتراقی آنمی آپلاستیک از PNH
غربالگری PNH با استفاده از فلوسیتومتری انجام میشود که دقیقاً نسبت گلبولهای قرمز و لکوسیتهای دارای کمبود پروتئین با GPI را اندازهگیری میکند. در PNH همولیتیک کلاسیک، کلون PNH بزرگ است، بالای 50٪ و گاهی اوقات تمام سلول های در گردش از کلون جهش یافته هستند. یک کلون بزرگ با افزایش خطر لخته وریدی فاجعه آمیز ارتباط دارد و نشانه ای برای نیاز به درمان ضد مکمل با اکولیزوماب است که همولیز داخل عروقی را تصحیح می کند .
پیشگیری موثری در برابر ترومبوز است. کلون ها معمولاً درآنمی آپلاستیک کوچک هستند و نیاز به نظارت دارند اما به درمان نیاز ندارند. PNH بالینی معمولاً از کلون های کوچک یا در غیاب یک کلون در هنگام تشخیص ایجاد نمی شود.
درمان آنمی آپلاستیک:
رویکردهای درمان کم خونی آپلاستیک در کودکان و بزرگسالان نشان داده شده است(شکل 2).
شکل 2
پیوند مغز استخوان
جایگزینی مغز استخوان شکست خورده درمان کننده بیماری زمینه ای است. از نظر تاریخی، پیوند به دلیل عوارض آن – رد پیوند و بیماری پیوند در مقابل میزبان (GVHD) – و نیاز به اهداکنندگان مناسب محدود شده است. گسترش گزینه های اهداکننده اخیرا پیشرفت بزرگی در این مورد ایجاد کرده است.
برای کم خونی آپلاستیک ایمنی در یک بیمار جوان، پیوند همیشه درمان ارجح است. هنگامی که پیوند به سرعت پس از تشخیص انجام شود، با استفاده از پیوند از یک اهداکننده خواهر یا برادر سازگار با بافت، نتایج عالی است، با نرخ بقای طولانی مدت بیش از 90 درصد در میان کودکان خردسالو بیش از 80 درصد در میان نوجوانان. نرخ پایین عوارض کوتاه مدت و بلند مدت.
اگرچه پیوند از اهداکنندگان خواهر و برادر در بزرگسالان مسنتر رایجتر شده است، نتایج برای چندین دهه بهبود نیافته است، با نرخ بقای حدود 50 درصد برای گیرندگان بالای 40 سال و خطر نسبی مرگ در دادههای رجیستری در بزرگسالان مسنتر نسبت به کودکان تقریباً سه برابر بیشتر است. بیماران سیاهپوست نیز پیامدهای ضعیفتری نسبت به بیماران سفیدپوست دارند.
همچنین استفاده از سرکوب کننده های سیستم ایمنی و تحریک سلول های بنیادی و استفاده از انروژن ها نیز از گزینه های درمانی بالقوه دیگر می باشد. بسیار خوشحال کننده است که درمان بیماران مبتلا به کم خونی آپلاستیک ایمنی به طور قابل توجهی در چند دهه گذشته به دلیل توسعه پیوندهای بهتر و رژیم های سرکوب کننده سیستم ایمنی بهبود یافته است. پیوند می تواند در همه انواع نارسایی مغز استخوان مفید باشد.
نویسنده و مترجم: فاطمه جوانی / کارشناسی ارشد هماتولوژی
منابع:
همچنین مطالب بیشتری را مطالعه فرمایید:
شکست پیوند سلول های بنیادی خونساز


 English
English